KALENDERBLATT JANUAR 2016
Langer Atem bei der Erforschung zwischenmolekularer Kräfte
Von 1966 bis 2009 war ich im Institut für Physikalische Chemie der Universität Rostock tätig. Dieses hatte seinen Sitz von Dezember 1956 bis Juli 2012 in einer Stadtvilla in der Hermannstr. 14 (früher Eigentum des Verlegers und Herausgebers des „Rostocker Anzeiger“ Carl Boldt). Ein großer Teil meiner Arbeit war auf Experiment und Theorie im Zusammenhang mit der Erforschung zwischenmolekularer Kräfte gerichtet. Dieses Forschungsprofil wurde im Institut für Physikalische Chemie seit Langem verfolgt. So wurde in Vorbereitung der 550-Jahr-Feier der Rostocker Universität 1969 in einer Publikation von Fischer et al. [1], die die Entwicklung der Fachrichtung Chemie nach der Wiedereröffnung der Universität Rostock 1946 beschrieb, festgestellt: „Unter der Leitung U. v. Webers (Berufung 1954) entwickelte sich die Forschungsrichtung des Instituts zu dem heutigen Profil mit der Thematik: Zwischenmolekulare Wechselwirkungen bei Nichtelektrolyt-Mischungen.“ Herausgewachsen aus und im Einklang mit der schwierigen theoretischen Bearbeitung der komplexen Wechselwirkungen in flüssigen Nichtelektrolyt-Mischungen, änderte sich unter der Leitung des 1974 berufenen Günther Opel (1928-2003) die Forschungsthematik Anfang der 1970erJahre dahingehend, dass die makroskopischen Eigenschaften von Gasen und Dämpfen und die zwischenmolekulare Wechselwirkung in diesen im Fokus der Untersuchungen standen. Dieser Übergang resultierte aus der Realgaskorrektur, die für die thermodynamische Behandlung flüssiger Mischungen benötigt wurde. 1989 in Vorbereitung auf die 575-Jahr-Feier der Universität Rostock erschienen „Rostocker Beiträge zur Untersuchung makroskopischer Größen von Gasen und zwischenmolekularer Wechselwirkungen“. [2] Diese betrafen Arbeiten zur Entwicklung von Apparaturen für die experimentelle Bestimmung von zweiten und dritten Druckvirialkoeffizienten, von ersten und zweiten dielektrischen Virialkoeffizienten, von Viskositätskoeffizienten sowie von Stoßzahlen aus thermomolekularen Druckdifferenzen zur Ermittlung von Wärmeleitfähigkeitskoeffizienten. Die Auswahl der untersuchten Substanzen erfolgte zum einen nach technisch-industriellen Gesichtspunkten, zum anderen immer stärker unter dem Aspekt, dass zu ihren zwischenmolekularen Wechselwirkungen auch ein theoretischer Zugang möglich erschien. So wurden Messungen u.a. an Wasserdampf, Methanol, Ethanol, Benzol, Phenol, Fluorbenzol, Ethen, Essigsäure und ihren Mischungen und schließlich auch an Edelgasen, Stickstoff, Kohlenmonoxid, Kohlendioxid, Methan und Tetrafluormethan über einen weiten Temperaturbereich (von Raumtemperatur bis 350° C) vorgenommen. In den unpolaren Spezies sowie in Benzol und weiteren experimentell untersuchten aromatischen Verbindungen (Toluol, p-Xylol, Mesitylen, Duren, Diphenyl) spielen die Dispersionswechselwirkungen eine von uns nie unterschätzte Rolle.
In den 1970er Jahren wurden die experimentellen Daten für die makroskopischen Eigenschaften oftmals noch dazu benutzt, um Parameter in verschiedenen Potentialansätzen zu bestimmen (Lennard-Jones-Ära). In diesen wurden die unterschiedlichen Beiträge von Abstoßungs-, Dispersions-, Induktions- und polaren Wechselwirkungen modellhaft berücksichtigt. Dabei zeigte sich aber, dass eine adäquate Beschreibung verschiedener makroskopischer Eigenschaften, die durch eine zwischenmolekulare oder wie im Fall der Edelgase nur zwischenatomare Wechselwirkung geprägt sind, mit diesen vereinfachten Ansätzen unmöglich ist. Damit rückten die Edelgasatome und ihre Paarpotentiale wieder in den Mittelpunkt des Interesses, wobei in den 1980er Jahren quantenmechanische Rechnungen für Abstoßungs- und Dispersionswechselwirkungen zusammen mit Schwingungsspektren schon zu Potentialfunktionen für alle fünf Edelgase führten, die einigermaßen konform im Hinblick auf die Beschreibung ihrer makroskopischen Eigenschaften waren. Allerdings waren noch Parameter mit Hilfe der experimentellen Daten für diese Eigenschaften zu adjustieren.
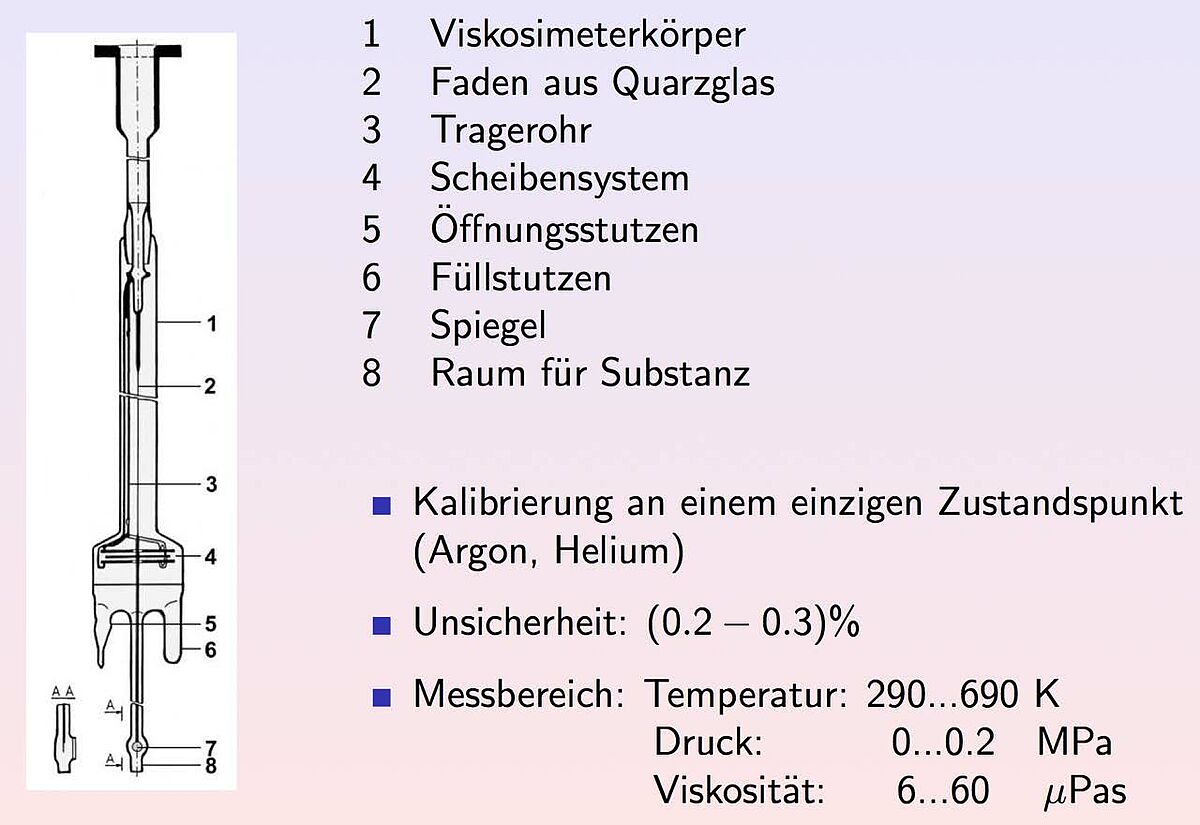
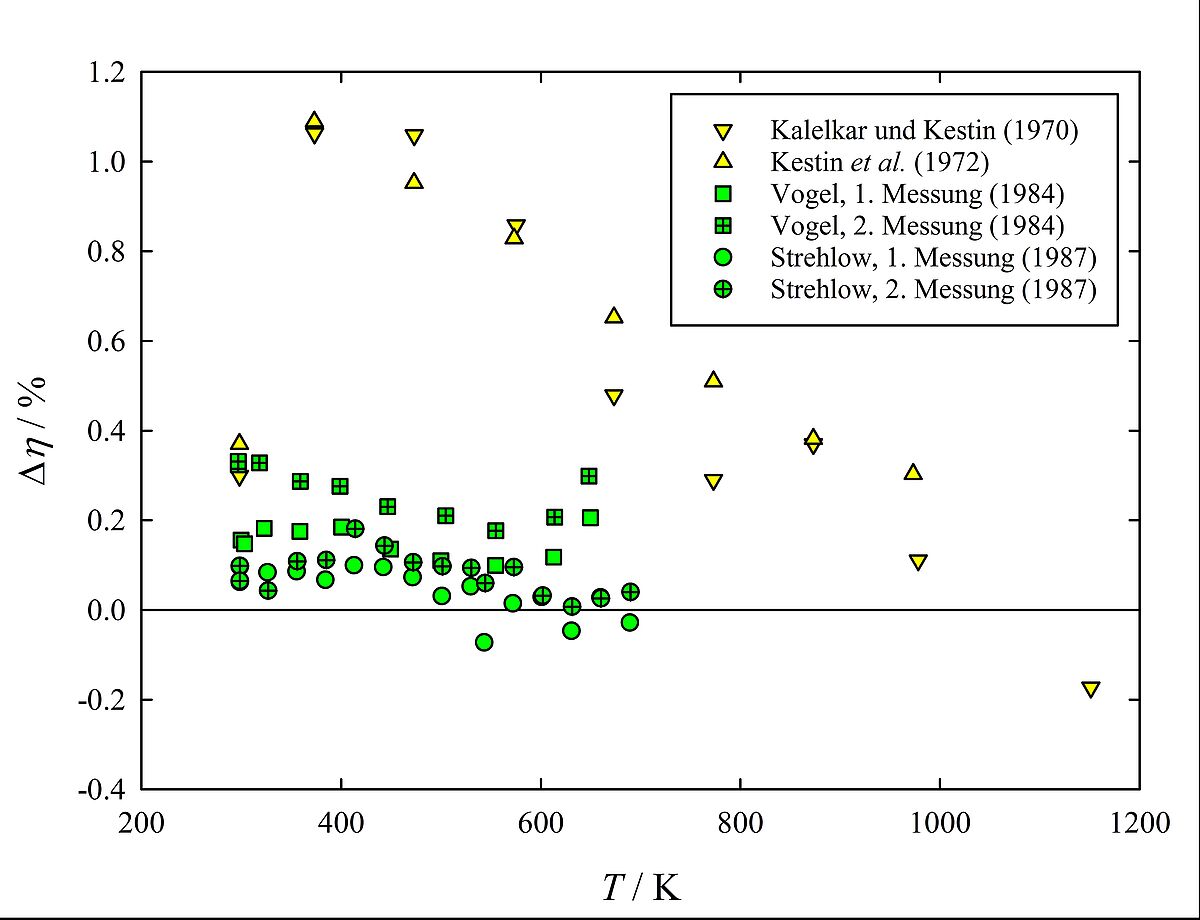
In den ersten Jahren meiner Tätigkeit am Institut war ich u.a. mit der Konstruktion und Arbeitsweise eines Quarzglas-Schwingscheibenviskosimeters und den damit im Temperaturbereich bis 400° C durchgeführten Messungen befasst (siehe Abb. 1). Mit dem bei Raumtemperatur mittels zuverlässig bekannter Viskositätskoeffizienten kalibrierten Instrument wurde eine Unsicherheit von (0.2-0.3) % auch für die höchsten Temperaturen bei Messungen an Stickstoff und den Edelgasen erreicht. Diese Resultate standen im Widerspruch zu den Ergebnissen einer weltweit renommierten Arbeitsgruppe in den USA (J. Kestin, Brown University, Providence, RI), die für ihre Werte die gleiche geringe Unsicherheit beanspruchte, während zwischen den Daten beider Gruppen Differenzen von mehr als 1% bestanden. 1985 wurde uns bewusst, dass die Entscheidung über die besseren Daten dann möglich ist, wenn die Viskositätskoeffizienten der Edelgase unter Ausnutzung quantenchemischer Rechnungen mittels der hochentwickelten kinetischen Theorie verdünnter Gase berechnet werden können. In Publikationen zu Helium (2007), Neon (2008), Argon (2009 und 2010) und Krypton (Abb. 2 zeigt die noch unveröffentlichten Ergebnisse) wurde nachgewiesen, dass die Resultate der Rostocker Viskositätsmessungen korrekt sind und die in unserer Arbeitsgruppe in Konkurrenz mit anderen Kollegen aus den USA seit Ende der 1990er Jahre entwickelten Paarpotentiale höchsten Ansprüchen genügen. [3] Seit 2000 hat sich die Arbeitsgruppe verstärkt der quantenchemischen Berechnung von Potentialhyperflächen für lineare zwei- und dreiatomige Moleküle (Stickstoff, Kohlenmonoxid und Kohlendioxid) sowie für mehratomige gewinkelte Moleküle (Wasser, Schwefelwasserstoff und Methan) zugewandt. Zur Unterstützung habe ich zum Ende meiner Tätigkeit noch zuverlässige Viskositätswerte für Stickstoff, Kohlenmonoxid, Kohlendioxid, Wasserdampf, Schwefelwasserstoff und Methan mit dem vorgenannten Schwingscheibenviskosimeter zwischen Raumtemperatur und 400° C ermittelt. Auf ihrer Grundlage wurden die Potentialhyperflächen der entsprechenden Moleküle geprüft, wozu eine adäquate kinetische Gastheorie und die dazugehörigen Berechnungsverfahren für Moleküle in Zusammenarbeit mit Kollegen aus Großbritannien entwickelt wurden. Die Ergebnisse der Forschungsarbeiten mit den ehemaligen Doktoranden und Kollegen wurden in etwa 30 Publikationen seit 2009 mitgeteilt. Auf dem Gebiet der Berechnung von Potentialhyperflächen und vor allem von Transporteigenschaften molekularer Gase ist meine ehemalige Arbeitsgruppe eine der international führenden, wie sie auch mit ihren Beiträgen in Ref. 3 zeigen konnte.
Eckhard Vogel
Quellen
[1] E. Fischer, H. Kelling, H. U. Kibbel, K. Uhle: Die Entwicklung der Fachrichtung Chemie an der Universität Rostock nach deren Wiedereröffnung 1946 und die Gründung der Sektion Chemie. In: Wiss. Z. Univ. Rostock, N-Reihe 1969, 18, S. 1019–1035.
[2] G. Opel, J. Millat: Rostocker Beiträge zur Untersuchung makroskopischer Größen von Gasen und zwischenmolekularer Wechselwirkungen. In: Wiss. Z. Univ. Rostock, N-Reihe 1989, 38(9), S. 51–59.
[3] E. Bich, J. B. Mehl, R. Hellmann, V. Vesovic: Dilute Gases. In: Experimental Thermodynamics. Cambridge: The Royal Society of Chemistry, Cambridge 2014, Vol. IX. Advances in Transport Properties of Fluids; Chapter 7, S. 226–252.